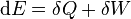Energi
Kerja dan panas adalah 2 contoh proses atau mekanisme yang dapat memindahkan sejumlah energi.
Hukum kedua termodinamika membatasi jumlah kerja yang didapat melalui proses pemanasan-beberapa diantaranya akan hilang sebagaipanas terbuang. Jumlah maksimum yang dapat digunakan untuk kerja disebut energi tersedia. Sistem seperti mesin dan benda hidup membutuhkan energi tersedia, tidak hanya sembarang energi. Energi mekanik dan bentuk-bentuk energi lainnya dapat berpindah langsung ke bentuk energi panas tanpa batasan tertentu.Dalam fisika, energi adalah properti fisika dari suatu objek, dapat berpindah melalui interaksi fundamental, yang dapat diubahbentuknya namun tak dapat diciptakan maupun dimusnahkan. Joule adalah satuan SI untuk energi, diambil dari jumlah yang diberikan pada suatu objek (melalui kerja mekanik) dengan memindahkannya sejauh 1 meter dengan gaya 1 newton.
Ada berbagai macam bentuk-bentuk energi, namun semua tipe energi ini harus memenuhi berbagai kondisi seperti dapat diubah ke bentuk energi lainnya, mematuhi hukum konservasi energi, dan menyebabkan perubahan pada benda bermassa yang dikenai energi tersebut. Bentuk energi yang umum diantaranya energi kinetik dari benda bergerak, energi radiasi dari cahaya dan radiasi elektromagnetik, energi potensial yang tersimpan dalam sebuah benda karena posisinya seperti medan gravitasi, medan listrik atau medan magnet, dan energi panas yang terdiri dari energi potensial dan kinetik mikroskopik dari gerakan-gerakan partikel tak beraturan. Beberapa bentuk spesifik dari energi potensial adalah energi elastis yang disebabkan dari pemanjangan atau deformasi benda padat danenergi kimia seperti pelepasan panas ketika bahan bakar terbakar. Setiap benda yang memiliki massa ketika diam, memiliki massa diam atau sama dengan energi diam, meski tidak dijelaskan dalam fenomena sehari-hari di fisika klasik.
Menurut neraca massa-energi, semua bentuk energi membutuhkan massa. Contohnya, menambahkan 25 kilowatt-jam (90 megajoule) energi pada objek akan meningkatkan massanya sebanyak 1 mikrogram; jika ada timbangan yang sebegitu sensitif maka penambahan massa ini bisa terlihat. Matahari mengubah energi potensial nuklir menjadi bentuk energi lainnya; total massanya akan berubah ketika energi terlepas ke sekelilingnya terutama dalam bentuk energi radiasi.
Meskipun energi dapat berubah bentuk, namun hukum kekekalan energi menyatakan bahwa total energi pada sebuah sistem hanya berubah jika energi berpindah masuk atau keluar dari sistem. Hal ini berarti tidak mungkin menciptakan atau memusnahkan energi. Total energi dari sebuah sistem dapat dihitung dengan menambahkan semua bentuk energi dalam sistem tersebut. Contoh perpindahan dan transformasi energi adalah pembangkitan listrik, reaksi kimia, atau menaikkan benda.
Organisme hidup juga membutuhkan energi tersedia untuk tetap hidup; manusia misalnya, membutuhkan energi dari makanan beserta oksigen untuk memetabolismenya. Peradaban membutuhkan pasokan energi untuk berbagai kegiatan; sumber energi seperti bahan bakar fosil merupakan topik penting dalam ekonomi dan politik. Iklim danekosistem bumi juga dijalankan oleh energi radiasi yang didapat dari matahari (juga energi geotermal yang didapat dari dalam bumi.
Satuan
SI dan satuan berhubungan
Satuan SI untuk energi dan kerja adalah joule (J), dinamakan untuk menghormati James Prescott Joule dan percobaannya dalam persamaan mekanik panas. Dalam istilah yang lebih mendasar 1 joule sama dengan 1 newton-meter dan, dalam istilah satuan dasar SI, 1 J sama dengan 1 kg m2 s−2.
| Gambar oleh Google |
Transfer energi
Kerja
Kerja didefinisikan sebagai "batas integral" gaya F sejauh s:
Persamaan di atas mengatakan bahwa kerja ( ) sama dengan integral dari dot product gaya (
) sama dengan integral dari dot product gaya ( ) di sebuah benda dan infinitesimal posisi benda (
) di sebuah benda dan infinitesimal posisi benda ( ).
).
 ) sama dengan integral dari dot product gaya (
) sama dengan integral dari dot product gaya ( ) di sebuah benda dan infinitesimal posisi benda (
) di sebuah benda dan infinitesimal posisi benda ( ).
).Jenis energi
Energi kinetik
Energi kinetik adalah bagian energi yang berhubungan dengan gerakan suatu benda.
Persamaan di atas menyatakan bahwa energi kinetik ( ) sama dengan integral dari dot product kecepatan (
) sama dengan integral dari dot product kecepatan ( ) sebuah benda dan infinitesimal momentum benda (
) sebuah benda dan infinitesimal momentum benda ( ).
).
 ) sama dengan integral dari dot product kecepatan (
) sama dengan integral dari dot product kecepatan ( ) sebuah benda dan infinitesimal momentum benda (
) sebuah benda dan infinitesimal momentum benda ( ).
).Energi potensial
Berlawanan dengan energi kinetik, yang adalah energi dari sebuah sistem dikarenakan gerakannya, atau gerakan internal dari partikelnya, energi potensial dari sebuah sistem adalah energi yang dihubungkan dengan konfigurasi ruang dari komponen-komponennya dan interaksi mereka satu sama lain. Jumlah partikel yang mengeluarkan gaya satu sama lain secara otomatis membentuk sebuah sistem dengan energi potensial. Gaya-gaya tersebut, contohnya, dapat timbul dari interaksi elektrostatik (lihat hukum Coulomb), atau gravitasi.
Energi dalam
Energi internal adalah energi kinetik dihubungkan dengan gerakan molekul-molekul, dan energi potensial yang dihubungkan dengan getaran rotasi dan energi listrik dari atom-atom di dalam molekul. Energi internal seperti energi adalah sebuah fungsi keadaan yang dapat dihitung dalam sebuah sistem.
| Gambar Oleh Google |
Termodinamika
Energi dalam
Energi dalam adalah jumlah dari semua elemen energi mikroskopik yang ada pada sistem. Energi dalam merupakan energi yang dibutuhkan untuk menciptakan sistem. Energi dalam berhubungan dengan energi potensial, seperti struktur molekul, struktur kristal, gerak partikel, dan aspek geometri lain. Termodinamika berfokus pada perubahan energi dalam, namun bukan nilai absolutnya.[2]
Hukum pertama termodinamika
Hukum pertama termodinamika menyatakan bahwa energi always conserved[3] dan aliran panas merupakan bentuk perpindahan energi. Untuk sistem homogen, dengan suhu dan tekanan yang telah ditentukan, rumus penurunan dari hukum pertama, bahwa sistem yang hanya berdasar dari gaya tekanan dan perpindahan panas (misalnya silinder penuh berisi gas), perubahan diferensial energi dalam sistem dirumuskan dengan
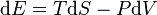 ,
,
dengan suku pertama di sebelah kanan adalah panas yang dipindahkan ke dalam sistem, dinyatakan dalam temperatur T dan entropi S (nilai entropi naik dan perubahan dSbernilai positif ketika sistem dipanaskan, dan suku terakhir di sebelah kanan adalah kerja yang dilakukan pada sistem, dimana tekanan P dan volume V (tanda negatif berasal dari kompresi pada sistem yang membutuhkan kerja yang dilakukan pada sistem sehingga perubahan volume, dV, bernilai negatif ketika kerja dilakukan pada sistem).
Persamaan ini sangat spesifik, mengabaikan semua energi kimia, listrik, nuklir maupun gravitasi. Rumus umum hukum pertama termodinamika nilainya tetap valid meskipun pada situasi dimana sistem tidak homogen. Untuk kasus ini, perubahan energi dalam pada sistem tertutup dinyatakan dengan
dengan  adalah panas yang masuk dalam sistem dan
adalah panas yang masuk dalam sistem dan 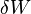 adalah kerja yang dilakukan pada sistem.
adalah kerja yang dilakukan pada sistem.
 adalah panas yang masuk dalam sistem dan
adalah panas yang masuk dalam sistem dan 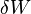 adalah kerja yang dilakukan pada sistem.
adalah kerja yang dilakukan pada sistem.| Gambar Oleh Google |
Sumber : Wikipedia
Refrensi :
- ^ Energy units are usually defined in terms of the work they can do. However, because work is an indirect measurement of energy, (One example of the difficulties involved: if you use thefirst law of thermodynamics to define energy as the work an object can do, you must perform a perfectly reversible process, which is impossible in a finite time.) many experts emphasize understanding how energy behaves, specifically the conservation of energy, rather than trying to explain what energy "is". "The Feynman Lectures on Physics Vol I.". Diakses 3 Apr 2014.
- ^ I. Klotz, R. Rosenberg, Chemical Thermodynamics - Basic Concepts and Methods, 7th ed., Wiley (2008), p.39
- ^ Kittel and Kroemer (1980). Thermal Physics. New York: W. H. Freeman. ISBN 0-7167-1088-9.